1 kapsul keras mengandungi 200 mg atau 250 mg crizotinib.
| Nama | Kandungan pakej | Bahan aktif | Harga 100% | Terakhir diubah suai |
| Xalkori | 60 biji, kapsul keras | Crizotinib | 2019-04-05 |
Tindakan
Perencat molekul kecil selektif reseptor tirosin kinase ALK (RTK) dan varian onkogeniknya (iaitu gabungan ALK dan mutasi ALK terpilih) dan perencat RTK reseptor faktor pertumbuhan hepatosit. Crizotinib menunjukkan penghambatan bergantung kepada kepekatan ALK dan c-Met kinase dalam ujian biokimia, dan menghalang fosforilasi dan fenotip bergantung kinase yang dimodulasi dalam ujian selular. Crizotinib menunjukkan aktiviti penghambatan pertumbuhan yang kuat dan selektif dan menyebabkan apoptosis pada barisan sel tumor yang dipengaruhi oleh kejadian jenis gabungan ALK (termasuk EML4-ALK dan NPM-ALK) atau penguatan lokus gen ALK atau MET. Crizotinib menunjukkan keberkesanan anti-tumor, termasuk aktiviti anti-tumor cytoreductive yang signifikan, pada tikus selepas tumor xenograft yang mengekspresikan protein gabungan ALK. Keberkesanan anti-tumor crizotinib bergantung pada dos dan berkorelasi dengan perencatan farmakodinamik fosforilasi protein fusi ALK (termasuk EML4-ALK dan NPM-ALK) pada tumor in vivo. Selepas satu dos oral dalam keadaan berpuasa, penyerapan crizotinib mencapai kepekatan maksimum dalam masa 4-6 jam.Dengan dos dua kali sehari, keadaan stabil dicapai dalam masa 15 hari. Ketersediaan bio mutlak crizotinib dianggarkan 43% selepas dos oral tunggal 250 mg. Ia 91% terikat dengan protein plasma. Kajian in vitro menunjukkan bahawa CYP3A4 / 5 adalah enzim utama yang terlibat dalam pembersihan metabolik crizotinib. Laluan metabolik utama pada manusia adalah pengoksidaan cincin piperidine ke crizotinib lactam dan O-dealkylation, diikuti oleh konjugasi fasa 2 metabolit O-dealkylated. T0.5 ialah 42 jam. 53% dan 2.3% dos crizotinib diberikan tidak berubah pada najis dan air kencing masing-masing.
Dos
Secara lisan. Semasa memenuhi syarat pesakit untuk mendapatkan rawatan, ujian yang tepat dan disahkan untuk ALK atau ROS1 mesti dilakukan. Penilaian NSCLC positif ALK-positif atau positif ROS1 harus dilakukan di makmal dengan pengalaman yang terbukti dalam teknologi khusus yang digunakan dalam ujian tersebut. Dewasa: 250 mg dua kali sehari, rawatan harus diteruskan sehingga perkembangan penyakit atau keracunan yang tidak dapat diterima. Setelah perkembangan penyakit objektif pada beberapa pesakit, pemanjangan rawatan dapat dipertimbangkan, tetapi tidak ada manfaat tambahan yang ditunjukkan. Sekiranya dos tidak dijawab, ubat harus diambil secepat mungkin, kecuali kurang dari 6 jam ke dos berikutnya. Penyesuaian dos. Bergantung pada keselamatan dan toleransi individu, pemberhentian ubat dan / atau pengurangan dos mungkin diperlukan. Apabila pengurangan dos diperlukan, dos harus dikurangkan menjadi 200 mg dua kali sehari. Sekiranya pengurangan dos lebih lanjut diperlukan, ia boleh disesuaikan menjadi 250 mg sekali sehari dengan mengambil kira keselamatan dan toleransi individu. Untuk tindak balas buruk hematologi (kecuali limfopenia): Gred 3 - ubat harus dihentikan sehingga tahap ≤2, kemudian disambung dengan jadual dos yang sama; Gred 4 - menghentikan rawatan ke Gred ≤2, kemudian kembali ke 200 mg dua kali sehari, dan sekiranya berlaku kambuh, berhenti ke Gred ≤2, kemudian kembali ke 250 mg sekali sehari, kemudian hentikan rawatan secara kekal pada Gred ≤2. Untuk pengulangan Gred 4. Sekiranya berlaku ketoksikan bukan-haematologi: Peningkatan ALT atau AST Gred 3 atau 4 dengan peningkatan bilirubin Gred ≤1. - Hentikan ubat sehingga darjah ≤1. atau asas, kemudian kembali ke 200 mg dua kali sehari; Peningkatan ALT atau AST Gred 2, 3 atau 4 dengan peningkatan kadar bilirubin Gred 2, 3 atau 4 serentak (sekiranya tiada kolestasis atau hemolisis) - menghentikan rawatan secara kekal; radang paru-paru dari mana-mana peringkat (tidak berkaitan dengan perkembangan NSCLC, penyakit paru-paru lain, jangkitan atau kesan radiasi) - menghentikan rawatan jika disyaki, dan berhenti secara kekal jika didiagnosis; Pemanjangan QTc Gred 3 - hentikan rawatan sehingga tahap ≤1, kemudian kembali ke 200 mg dua kali sehari; Pemanjangan QTc Gred 4 - menghentikan rawatan secara kekal; Bradikardia Gred 2 atau 3 - hentikan sehingga tahap ≤ 1 atau denyut jantung 60 atau lebih tinggi, nilaikan agen bradikardia bersamaan dan juga agen antihipertensi - jika bradikardia disebabkan dan dihentikan atau pengubahsuaian dos , sambung semula dos crizotinib yang telah digunakan sebelumnya ketika darjah ≤ 1 atau denyut jantung 60 atau lebih tinggi, dan jika penyebab bradikardia belum diketahui atau ubat belum dihentikan atau diselaraskan dos, mulakan semula crizotinib pada dos yang dikurangkan. dos setelah mencapai Gred ≤ 1 atau degupan jantung 60 atau lebih tinggi; Bradikardia Gred 4 - menghentikan rawatan secara kekal jika penyebab bradikardia tidak ditentukan mana ubat yang bersamaan; Sekiranya penyebab utama bradikardia dikenal pasti dan dosnya dihentikan atau dosnya diubah, mulakan rawatan dengan 250 mg sekali sehari setelah mencapai Gred ≤ 1 atau dengan kadar jantung 60 atau lebih tinggi, dengan pemantauan yang kerap; Gangguan mata kelas 4 (kehilangan penglihatan) - menghentikan rawatan. Kumpulan pesakit khas. Tidak diperlukan penyesuaian dos permulaan crizotinib pada pesakit dengan gangguan hepatik ringan atau pada orang tua. Pada pesakit dengan gangguan hati yang sederhana, dos permulaan yang disyorkan adalah 200 mg dua kali sehari. Pada pesakit dengan fungsi hati yang sangat berkurang, dos permulaan yang disyorkan adalah 250 mg sekali sehari. Pada pesakit dengan gangguan ginjal yang teruk yang tidak memerlukan dialisis peritoneal atau hemodialisis, dos permulaan crizotinib oral harus dikurangkan menjadi 250 mg sekali sehari. Selepas sekurang-kurangnya 4 minggu rawatan, dos dapat ditingkatkan menjadi 200 mg dua kali sehari bergantung pada keselamatan dan toleransi individu. Ubat itu boleh diberikan dengan atau tanpa makanan. Topi. jangan hancurkan, larut atau buka.
Petunjuk
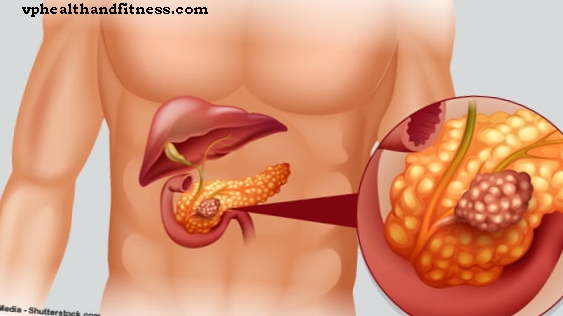
Rawatan lini pertama pesakit positif ALK dewasa (dengan penyusunan semula gen gen limfoma anaplastik) dengan barah paru-paru sel bukan kecil (NSCLC ALK-positif).Rawatan pesakit dewasa dengan kanser paru-paru sel kecil bukan ALK positif yang dirawat sebelumnya. Rawatan pesakit dewasa dengan kanser paru-paru sel kecil bukan positif positif ROS1.
Kontraindikasi
Hipersensitiviti terhadap crizotinib atau mana-mana eksipien.
Langkah berjaga-berjaga
Hepatotoksisitas akibat dadah yang menyebabkan kematian telah dilaporkan pada kurang dari 1% pesakit dalam ujian klinikal, serta peningkatan bersamaan ALT hingga lebih dari 3 x ULN (had atas normal) dan jumlah bilirubin menjadi lebih besar daripada 2 x ULN tanpa meningkat aktiviti fosfatase alkali. Kenaikan parameter makmal pada tahap 3 dan 4 secara amimtomatik dan diselesaikan setelah pemberhentian ubat. Peningkatan transaminase secara amnya berlaku dalam 2 bulan pertama rawatan. Gunakan dengan berhati-hati pada pesakit dengan gangguan hati. Ujian fungsi hati harus dilakukan termasuk pengukuran ALT, AST, dan jumlah bilirubin dua kali sebulan untuk 2 bulan pertama rawatan, dan kemudian setiap bulan selepas itu dan seperti yang ditunjukkan secara klinikal, dengan ujian yang lebih kerap diperlukan untuk kenaikan Gred 2. 3 dan 4 Dalam ujian klinikal, 1% pesakit dikaitkan dengan perkembangan radang paru-paru yang teruk, mengancam nyawa atau maut pada 1% pesakit. Pesakit harus dipantau untuk perkembangan gejala pernafasan yang menunjukkan radang paru-paru. Sekiranya disyaki radang paru-paru, rawatan harus dihentikan. Punca lain dari pneumonia harus dikesampingkan dan rawatan harus dihentikan secara kekal pada pesakit dengan pneumonia yang berkaitan dengan rawatan. Selain itu, pemanjangan selang QTc telah diperhatikan, yang boleh menyebabkan peningkatan risiko tachyarrhythmia ventrikel (mis., Torsade de pointes) atau kematian mendadak. Risiko pemanjangan QTc mungkin lebih besar pada pesakit yang mengambil ubat antiaritmia bersamaan dan pada pesakit dengan penyakit jantung yang mendasari, bradikardia atau gangguan elektrolit (mis. Sekunder untuk cirit-birit dan muntah); berhati-hati harus dilakukan pada pasien ini dan pemantauan berkala terhadap elektrokardiogram dan elektrolit harus dipertimbangkan semasa ubat sedang digunakan. Penggunaan bersamaan dengan crizotinib dengan ubat lain yang memperlahankan kadar jantung (mis. Beta blocker, penyekat saluran kalsium selain dihydropyridine seperti verapamil dan diltiazem, clonidine, digoxin) harus dielakkan jika mungkin kerana peningkatan risiko bradikardia simptomatik. Denyut jantung dan tekanan darah harus dipantau secara berkala. Untuk cadangan rawatan pada pesakit yang mengalami bradikardia simptomatik, lihat Posologi. Reaksi buruk yang serius, mengancam nyawa atau maut seperti kegagalan jantung telah dilaporkan dalam ujian klinikal dan dalam keadaan pasca pemasaran. Pesakit, baik dengan dan tanpa gangguan jantung yang ada, menerima crizotinib harus dipantau untuk tanda-tanda dan gejala kegagalan jantung (dyspnoea, edema, kenaikan berat badan yang cepat kerana pengekalan cecair). Sekiranya gejala seperti itu diperhatikan, pertimbangan harus diberikan untuk menghentikan sementara rawatan, mengurangkan dos, atau menghentikan rawatan. Oleh kerana kerap berlaku neutropenia dan leukopenia, pesakit harus dipantau dengan jumlah darah dengan smear seperti yang ditunjukkan secara klinikal, dan ujian yang lebih kerap diperlukan sekiranya terdapat kelainan, demam atau jangkitan Gred 3 atau 4. Kes berlubang GI, dengan hasil maut, telah dilaporkan dalam pengalaman pasca pemasaran dengan crizotinib. Ubat ini harus digunakan dengan berhati-hati pada pesakit yang berisiko mengalami perforasi gastrointestinal (mis. Dengan riwayat diverticulitis, metastasis gastrointestinal, rawatan bersamaan dengan produk perubatan dengan risiko perforasi gastrointestinal yang diketahui). Crizotinib harus dihentikan pada pesakit yang mengalami perforasi gastrointestinal. Pemantauan fungsi ginjal dianjurkan pada pesakit pada awal dan semasa rawatan dengan crizotinib. Perhatian khusus harus diberikan pada pesakit dengan faktor risiko atau riwayat gangguan buah pinggang. Bagi pesakit dengan gangguan ginjal yang teruk yang tidak memerlukan dialisis peritoneal atau hemodialisis, dos crizotinib harus disesuaikan. Sekiranya terdapat gangguan visual yang berterusan atau semakin teruk, perlu dilakukan perundingan oftalmologi. Terdapat data terhad yang terdapat pada pesakit yang didiagnosis dengan NSCLC positif ALK-positif atau positif ROS1 selain adenokarsinoma, termasuk karsinoma sel skuamosa.
Aktiviti yang tidak diingini
Sangat biasa: neutropenia, anemia, leukopenia, penurunan selera makan, neuropati, dysgeusia, penglihatan kabur, pening, bradikardia, muntah, mual, cirit-birit, sembelit, sakit perut, peningkatan transaminase, ruam, keletihan, bengkak. Biasa: hipofosfatemia, kegagalan jantung, ECG QT berpanjangan, sinkop, pneumonia interstisial, esofagitis, dispepsia, fosfatase alkali darah meningkat, sista ginjal, kreatinin darah meningkat, testosteron darah menurun. Tidak biasa: perforasi gastrointestinal, kegagalan hati, kegagalan buah pinggang akut, kegagalan buah pinggang.
Kehamilan dan penyusuan
Jangan gunakan ubat ini semasa kehamilan, kecuali jika keadaan klinikal wanita memerlukan rawatan. Ubat tersebut boleh membahayakan anak yang belum lahir ketika digunakan semasa kehamilan. Kajian haiwan menunjukkan ketoksikan pembiakan. Wanita hamil atau wanita yang hamil semasa mengambil crizotinib, dan lelaki yang hamil semasa menerima pasangannya, harus diberitahu tentang potensi bahaya pada janin. Tidak diketahui sama ada crizotinib dan metabolitnya diekskresikan dalam susu manusia - penyusuan susu ibu harus dielakkan semasa mengambil ubat ini. Wanita yang berpotensi melahirkan anak harus dinasihatkan untuk tidak hamil semasa mengambil ubat ini. Kontrasepsi yang mencukupi harus digunakan semasa terapi dan sekurang-kurangnya 90 hari setelah menghentikan rawatan. Kesuburan. Ubat ini boleh merosakkan kesuburan lelaki dan wanita. Lelaki dan wanita harus mendapatkan nasihat mengenai pemeliharaan kesuburan sebelum rawatan.
Komen
Perlu berhati-hati semasa memandu atau mengoperasikan mesin, kerana kemungkinan gangguan visual, pening atau keletihan.
Interaksi
Pemberian bersama crizotinib dengan perencat kuat CYP3A boleh meningkatkan kepekatan plasma crizotinib; Penggunaan perencat CYP3A yang kuat harus dielakkan (sebilangan perencat protease seperti atazanavir, indinavir, nelfinavir, ritonavir, saquinavir dan beberapa antikulat azole seperti itraconazole, ketoconazole dan voriconazole, dan beberapa makrolida, seperti clarithromycin, troleithromycin, troleithromycin, troleithromycin, troleithromycin, troleithromycin, troleomromycin, troleithromycin, troleithromycin, troleithromycin, troleithromycin, troleithromycin, troleithromycin, troleomromycin, troleithromycin, troleithromycin. Jus limau gedang dan limau gedang juga dapat meningkatkan kepekatan plasma crizotinib dan harus dielakkan. Selain itu, kesan perencat CYP3A terhadap pendedahan kepada crizotinib pada keadaan stabil belum dapat dipastikan. Pemberian bersama crizotinib dengan penginduksi CYP3A yang kuat boleh mengurangkan kepekatan plasma crizotinib; Penggunaan bersamaan pemicu CYP3A yang kuat, termasuk tetapi tidak terhad kepada carbamazepine, phenobarbital, phenytoin, rifabutin, rifampicin, dan St. John's wort, harus dielakkan. Selain itu, kesan pemicu CYP3A terhadap pendedahan keadaan mantap pada crizotinib belum dapat diketahui. Pemberian bersama crizotinib dengan substrat CYP3A dengan indeks terapeutik yang sempit, termasuk alfentanil, cisapride, siklosporin, derivatif ergotamin, fentanil, pimozide, quinidine, sirolimus dan tacrolimus harus dielakkan; Apabila terapi kombinasi diperlukan, pemantauan klinikal yang dekat harus dilakukan. Kajian in vitro menunjukkan bahawa crizotinib adalah penghambat CYP2B6, oleh itu crizotinib dapat meningkatkan kepekatan plasma persiapan bersama yang dimetabolisme oleh CYP2B6 (mis. Bupropion, efavirenz). Kajian in vitro pada hepatosit manusia menunjukkan bahawa crizotinib dapat menyebabkan enzim yang diatur oleh reseptor kehamilan X (PXR) dan reseptor androstana (CAR) . Walau bagaimanapun, tidak ada induksi in vivo yang diperhatikan ketika crizotinib diberikan bersama dengan midazolam substrat penyelidikan CYP3A4. Perhatian harus diberikan semasa pemberian crizotinib dengan ubat-ubatan yang terutama dimetabolisme oleh enzim ini. Perlu diingat bahawa keberkesanan kontraseptif oral yang digunakan bersamaan boleh berubah. Kesan penghambatan crizotinib pada UGT, khususnya UGT1A1, belum diketahui; Berhati-hati harus diberikan semasa memberikan crizotinib dalam kombinasi dengan substrat UGT seperti paracetamol, morfin atau irinotecan. Berdasarkan kajian in vitro, crizotinib diharapkan dapat menghalang P-gp usus, oleh itu pemberian crizotinib dengan sediaan yang merupakan substrat P-gp (mis. Digoxin, dabigatran, colchicine, pravastatin) dapat meningkatkan kesan terapi mereka dan menimbulkan kesan sampingan; Pemantauan klinikal yang dekat disarankan apabila crizotinib diberikan dengan ubat-ubatan ini. Dalam ujian klinikal, pemanjangan QT diperhatikan dengan crizotinib; penggunaan bersamaan dengan crizotinib dengan ubat-ubatan yang diketahui memanjangkan selang QT atau ubat-ubatan yang boleh menyebabkan torsade de pointes (mis. kelas IA atau antiarrhythmics kelas III , metadon, cisapride, moxifloxacin, neuroleptik, dan lain-lain); sekiranya terapi kombinasi dengan ubat-ubatan ini, selang QT harus dipantau. Bradikardia telah dilaporkan dalam ujian klinikal, oleh itu bradikardia telah dilaporkan apabila crizotinib digunakan dalam kombinasi dengan agen pelambat jantung (contohnya penyekat saluran kalsium selain daripada derivatif dihydropyridine seperti verapamil dan diltiazem, penyekat beta, clonidine, guanfacin, digoxin, inhibitor mefloquine, ), berhati-hati harus dilakukan kerana risiko bradikardia.
Penyediaannya mengandungi bahan: Crizotinib
Ubat ganti rugi: TIDAK