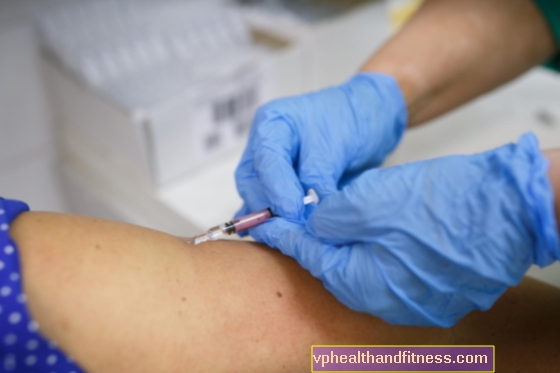
Ujian klinikal adalah asas perubatan moden. Mereka perlu untuk memeriksa sama ada bahan dalam ubat itu selamat, berkesan dan lebih baik daripada yang ada. Terima kasih kepada mereka, adalah mungkin untuk belajar tentang yang baru dan mengembangkan strategi terapi yang ada, dan untuk meneroka pengetahuan mengenai keberkesanan dan keselamatan ubat-ubatan. Sebelum setiap ubat itu dijual, ia mesti menjalani beberapa siri ujian tersebut.
Ujian klinikal telah dilakukan di negara kita sejak awal tahun 1990-an oleh institusi penyelidikan, yayasan dan syarikat farmaseutikal. Dengan bermulanya ujian klinikal, standard rawatan perubatan yang lebih tinggi dan rawatan yang lebih moden dan alternatif mula diperkenalkan. Jawatankuasa Bioetika dan Central Register of Clinical Research (CEBK) ditubuhkan, kemudian dinamakan semula sebagai Pejabat Pendaftaran Produk Ubat, Alat Perubatan dan Bahan Biocidal.
Untuk melindungi keselamatan dan hak orang yang berpartisipasi dalam ujian klinikal dan untuk memastikan kebolehpercayaan data yang diperoleh, peraturan Praktik Klinikal Baik (GCP) dikembangkan dan dilaksanakan. Ini adalah standard etika dan saintifik antarabangsa untuk merancang, menjalankan, mendokumentasikan, dan melaporkan hasil penyelidikan ubat-ubatan manusia.
Untuk memulakan penyelidikan di mana penguji adalah orang, adalah perlu untuk mengemukakan permohonan izin kepada Presiden Pejabat Pendaftaran Produk Ubat, Alat Perubatan dan Produk Biocidal dan komisen bioetika yang berkaitan. Presiden Pejabat mempunyai 60 hari untuk mengeluarkan keputusan. Kajian ini hanya boleh dimulakan setelah persetujuan kedua-dua pihak berkuasa. Ujian klinikal biasanya dilakukan di hospital atau pusat penyelidikan perubatan.
- Mereka mesti dijalankan oleh orang yang mempunyai kelayakan profesional yang cukup tinggi, pengetahuan saintifik dan pengalaman dalam bekerja dengan pesakit - kata Dr Wojciech Łuszczyna, jurucakap Pejabat Pendaftaran Produk Ubat, Alat Perubatan dan Produk Biocidal.
Sebilangan besar ubat baru dalam onkologiSebilangan besar ujian klinikal dijalankan di Amerika Syarikat dan Eropah Barat.
- Di Poland, jumlah ujian yang didaftarkan tetap stabil selama 10 tahun terakhir - kira-kira 400-500 ujian dilakukan setiap tahun. Lebih 20 peratus penyelidikan berdaftar berkaitan onkologi. Bidang perubatan lain yang sering berkaitan dengan penyelidikan yang didaftarkan di Poland adalah: neurologi, dermatologi, gastroenterologi, kardiologi, diabetesologi, reumatologi dan pulmonologi - kata Wojciech Łuszczyna. Presiden Pejabat Pendaftaran Produk Ubat, Alat Perubatan dan Bahan Biocidal menyimpan Central Register of Clinical Trials (CEBK), yang mengandungi, antara lain, maklumat mengenai produk perubatan penyiasatan, laman penyelidikan dan penyelidik. - Walau bagaimanapun, daftar ini tidak tersedia untuk orang ramai.
Namun, terdapat daftar percubaan klinikal Eropah yang tersedia untuk umum, yang mengandungi data mengenai percubaan yang sedang berlangsung di Kesatuan Eropah, termasuk data dari Poland. Ia boleh didapati di www.clinicaltrialsregister.eu. Data dalam pendaftaran berasal dari pangkalan data ujian klinikal Eropah (EudraCT). Penyelidikan ini muncul dalam daftar setelah memasukkan maklumat pangkalan data mengenai izin yang dikeluarkan oleh pihak berkuasa dan maklumat mengenai pendapat positif jawatankuasa bioetika yang kompeten - tambah Wojciech Łuszczyna.
Baca juga: Rawatan barah: terapi yang disasarkan dengan senjata untuk melawan barah Bilakah pesakit yang tidak diinsuranskan dapat perkhidmatan NHF percuma? Dari idea ke farmasi. Bagaimana ubat dibuat?Penemuan terobosan berkat penyelidikan klinikal
Berkat ujian klinikal, hari ini kita mempunyai banyak ubat dan terapi baru, dan sehingga baru-baru ini penyakit yang tidak dapat dirawat dapat berjaya dirawat. Pada tahun 1999, hanya 3 dari 10 pesakit yang didiagnosis dengan leukemia bertahan hingga 5 tahun. Pada masa ini, dalam banyak kes, rawatan berkesan dan tidak hanya menghentikan perkembangan penyakit, tetapi juga menyembuhkan pesakit sepenuhnya.
Pada gilirannya, berkat pengembangan protease inhibitor dan penyelidikan seterusnya untuk meningkatkan ubat dan terapi, kadar kematian di kalangan pesakit AIDS telah menurun sebanyak 70%. Berkat ubat baru, pesakit setelah berjaya melakukan transplantasi menikmati nyawa mereka yang selamat dan kembali sihat. Pada masa lalu, pesakit yang memerlukan pemindahan organ dalaman tidak mempunyai peluang seperti itu kerana sistem kekebalan tubuh menyebabkan penolakan organ yang dipindahkan dari penderma yang tidak berkaitan. Penyelidikan ini terbukti berkesan, yang menyebabkan penghapusan hampir semua penyakit, seperti penyakit Heine-Medina (polio). 50 tahun yang lalu, jangkitan dengan penyakit ini dikaitkan dengan dengan risiko kematian yang tinggi atau kelumpuhan otot kekal. Berkat penemuan vaksin, vaksin ini berjaya dibendung di kebanyakan wilayah di dunia. Pertubuhan Kesihatan Sedunia (WHO) mengumumkan pada tahun 2002 bahawa Eropah bebas polio.
Empat fasa ujian klinikal
Ujian klinikal dijalankan mengikut peraturan yang ditentukan dengan ketat. Peserta yang sihat dan sakit memainkan peranan utama. Tanpa mereka, tidak mungkin untuk menentukan apakah ubat yang diberikan berkesan dan selamat, jadi tidak akan ada kesempatan untuk memperkenalkan ubat yang lebih banyak dan lebih berkesan. Oleh itu, sangat penting untuk memastikan keselamatan sukarelawan dan menghormati hak mereka. Ujian klinikal dibahagikan kepada 4 fasa, masing-masing mesti berjaya untuk memulakan fasa seterusnya.
Tahap pertama kerja bahan yang akan digunakan dalam perubatan adalah tahap penyelidikan praklinikal. Pertama, sebatian tersebut diuji pada sel in vitro (tumbuh di luar organisma hidup dalam keadaan makmal) dan kemudian pada haiwan eksperimen. Kajian sedemikian mungkin memakan masa hingga beberapa tahun. Atas sebab keselamatan pesakit, ubat tersebut tidak boleh diletak di pasaran hanya berdasarkan ujian makmal dan kajian haiwan. Oleh itu, penyelidikan di mana pesakit ujian mengambil bahagian adalah perlu.
Tahap I ujian klinikal
Oleh itu, peringkat seterusnya adalah ujian klinikal yang melibatkan orang yang sihat (fasa I), yang tujuannya adalah untuk mengesahkan atau mengesahkan analisis sebelumnya dan pengetahuan yang diperoleh. Semasa fasa pertama, keselamatan bahan tertentu dinilai, dan beberapa lusin sukarelawan yang sihat menguji penyerapan, metabolisme, perkumuhan dan toksisitasnya. Interaksi zat dengan makanan dan ubat yang biasa digunakan juga diperiksa.
Hasil bahagian kerja ini membantu menentukan dos awal. Percubaan Tahap I dijalankan di pusat penyelidikan yang dimiliki oleh syarikat farmaseutikal atau institusi saintifik. Dalam kes penyelidikan mengenai bahan untuk rawatan barah dan penyakit mental, fasa I digabungkan dengan fasa II agar tidak memberi gambaran sukarelawan yang sihat kepada kesan sebatian yang sangat toksik.
Ujian klinikal Tahap II
Tujuan ujian klinikal fasa II adalah untuk menentukan sama ada ubat baru berfungsi pada kumpulan pesakit tertentu dan adakah ia selamat. Hubungan antara dos dan kesan bahan juga dinilai, yang menghasilkan penentuan dos yang digunakan pada fasa kajian berikutnya.
Pada peringkat penyelidikan ini, kesan ubat baru dan yang disebut plasebo, atau ubat yang sudah terkenal dengan rawatan penyakit tertentu. Beberapa ratus sukarelawan yang menderita penyakit tertentu mengambil bahagian dalam fasa penyelidikan ini.
Ujian klinikal Tahap III
Pada fasa ketiga ujian klinikal, yang dilakukan dengan beberapa ribu pesakit, akhirnya disahkan sama ada ubat yang diuji berkesan dalam rawatan penyakit tertentu. Tujuan bahagian kerja penyelidikan ini adalah untuk menentukan hubungan antara keselamatan bahan dan keberkesanan dalam penggunaan jangka pendek dan jangka panjang.
Bahagian penyelidikan ini mungkin memakan masa dari satu hingga beberapa tahun.
Tahap IV ujian klinikal
IV - fasa terakhir ujian klinikal berkaitan dengan ubat yang didaftarkan dan dipasarkan. Tujuannya adalah untuk menentukan sama ada ubat itu selamat dalam semua petunjuk yang disyorkan oleh pengilang dan untuk semua kumpulan pesakit.
Ujian klinikal - maklumat untuk pesakit
Menyertai ujian klinikal adalah sukarela, namun memerlukan persiapan dan renungan yang sewajarnya. Doktor yang bertindak sebagai penyelidik memutuskan sama ada seseorang itu memenuhi kriteria perubatan. Dianggarkan bahawa setiap tahun beberapa ribu pesakit Poland memberi persetujuan mereka untuk menyertai ujian klinikal ubat baru. Menurut anggaran Persatuan Amalan Penyelidikan Klinikal yang Baik di Poland, setakat ini kira-kira 200,000 orang dapat mengambil bahagian dalam kajian ini. orang. Bagi sebilangan pesakit, ini adalah peluang untuk memulai terapi bentuk moden, meningkatkan kualiti hidup. Selain akses kepada terapi inovatif, sukarelawan dikaji dengan teliti. Adalah tidak biasa untuk mengungkapkan penyakit yang sebaliknya tidak dapat dikesan.
Perlu diketahui bahawa peserta ujian dadah mempunyai hak untuk mendapatkan maklumat mengenai keadaan kesihatannya pada setiap peringkat penyelidikan.
Mana-mana sukarelawan yang bersetuju untuk mengambil bahagian dalam kajian ini boleh, pada bila-bila masa, dengan pelbagai alasan, menarik diri tanpa mengalami akibat. Dia harus memberitahu doktor mengenai keputusannya dan menghadiri pemeriksaan sehingga doktor dapat menilai kesihatannya setelah mengikuti ujian.
Doktor diwajibkan untuk memberitahu peserta mengenai data baru yang, misalnya, dapat mempengaruhi keputusan penyertaan selanjutnya.
Penyertaan dalam penyelidikan adalah percuma bagi pesakit. Penaja kajian akan menanggung kos ubat, ujian pakar dan rawatan perubatan, dan kos rawatan kesan sampingan.
Adakah penyertaan dalam ujian klinikal selamat? Selalu ada risiko
Ujian klinikal dikenakan prosedur yang sangat terperinci dan kawalan ketat pada setiap peringkat. Ini diperlukan untuk mengurangkan kemungkinan risiko yang berkaitan dengan menanggungnya bagi mereka yang mengambil bahagian di dalamnya.
- Semasa merancang percubaan klinikal, potensi risiko dan ketidaknyamanan harus ditimbang dengan manfaat yang diharapkan bagi peserta percubaan dan masyarakat. Potensi faedah bagi individu dan masyarakat yang dihasilkan dari tingkah lakunya mesti membenarkan risiko yang mungkin terdedah kepada peserta kajian, kata Wojciech Łuszczyna. Peserta kajian terdedah kepada kesan buruk ubat yang diuji atau akibat negatif dari prosedur yang berkaitan dengan kajian yang dilakukan. Orang yang mengalami masalah kesihatan kekal semasa ujian dadah berhak mendapat pampasan.
Artikel yang disyorkan:
Ubat biologi berbanding biosimilar: hampir membuat perbezaan besarSumber:
https://pacjentwbadaniem.pl
https://www.badaniaklinicznewpolsce.pl/#/
Persatuan Amalan Penyelidikan Klinikal yang Baik di Poland https://www.gcppl.org.pl



---normy-w-badaniu-krwi.jpg)